La sécurité des prothèses mammaires une nouvelle fois mise à mal après la découverte d’un cancer rare

Doit-on s’inquiéter de voir des prothèses mammaires à nouveau liées à un scandale peu de temps après l’affaire PIP ?
Alors que la large médiatisation de l’affaire concernant des prothèses frauduleuses PIP a terni l’image de dispositifs médicaux et de leur contrôle (I), un nouveau scandale pointe du doigt des prothèses mammaires, sensées favoriser un certain type de lymphome (II). L’Union européenne a d’ores et déjà entrepris une révision de la règlementation existante en matière de dispositifs médicaux (III).
I – Le scandale sanitaire des prothèses PIP
Rappellons qu’en 2010, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) tirait la sonnette d’alarme après différentes plaintes déposées par des patientes porteuses de prothèses mammaires de marque Poly Implant Prothèses (PIP). En effet, après avoir constaté un taux de rupture nettement supérieur à la moyenne, la lumière avait été faite sur ce fabricant varois peu scrupuleux. Celui-ci n’avait pas hésité à utiliser du gel frelaté pour remplir des prothèses mammaires qu’il vendait en France et à l’international, tout en manipulant les organismes contrôlant la régularité de ses produits. Le fabricant avait alors avoué aux autorités qu’il utilisait un gel artisanal non conforme dans 75% de ses produits, différent de celui qu’il déclarait aux organismes certificateurs lui permettant de distribuer ses prothèses en toute légalité. L’enquête avait notamment permis de retrouver dans le gel litigieux de l’huile de silicone destinée à un usage industriel (additif pour carburant ou agents d’enrobage de câbles électriques), dont les effets sur la santé humaine n’ont jamais été testés. De toute évidence, ces produits sont interdits dans tout dispositif médical. Alors que les pouvoirs publics avaient conseillé aux porteuses d’implants PIP un retrait préventif tout en bannissant ces dispositifs du marché, le chef d’entreprise avait écopé de 4 ans de prison. L’organisme certificateur avait, lui, dû verser 60 millions d’euros à des plaignantes.
II – Un nouveau scandale relatif à un risque de cancer causé par certaines prothèses
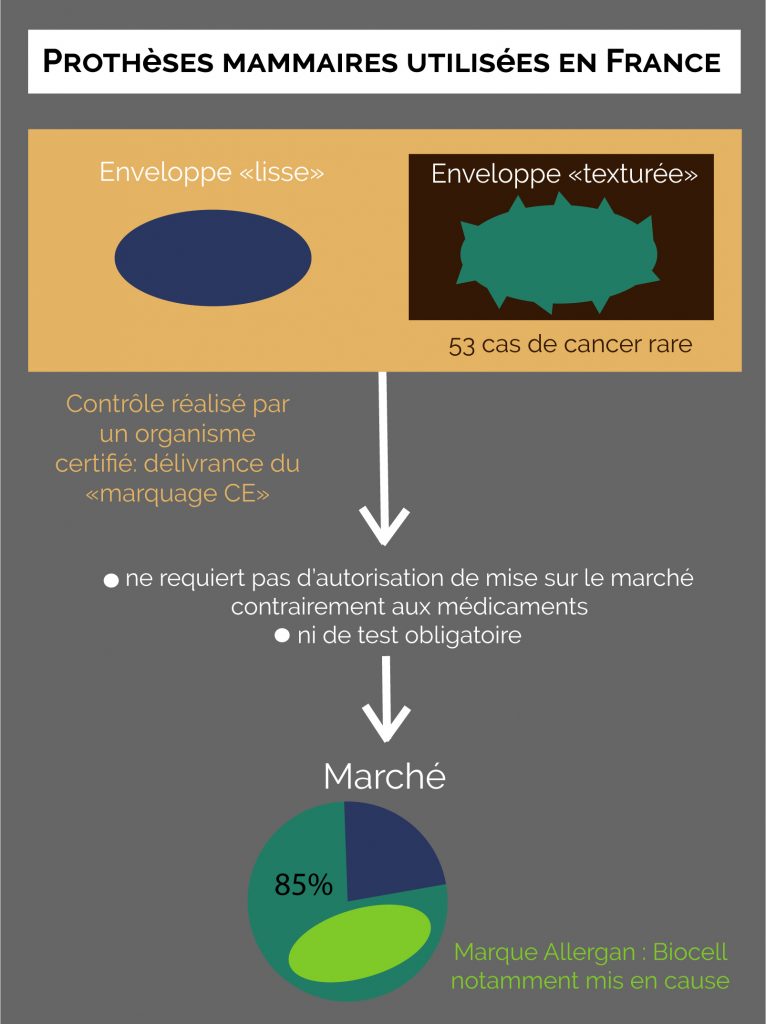
Aujourd’hui, ce n’est pas un gel en silicone frauduleux qui est pointé du doigt, mais un type de prothèses. En effet, après plus d’une cinquantaine de cas en France, l’ANSM ainsi qu’un comité d’experts concluent que les prothèses texturées favoriseraient un type de cancer rare, le lymphome anaplastique à grandes cellules. Ce cancer localisé dans la poitrine, découvert à la fin des années 2000 ne toucherait que les porteuses d’implants mammaires, dont la quasi-totalité serait de type texturé, en opposition aux prothèses « lisses ». Si l’intérêt des textures de prothèses mammaires est encore actuellement discuté, les fabricants et certains professionnels de santé avançaient l’avantage des prothèses texturées : celles-ci seraient susceptibles d’éviter des complications et de mieux adhérer au corps. Problème : ce pourrait être cet aspect granuleux de la prothèse qui provoquerait ce lymphome rare. Les chiffres : depuis 2011, 53 femmes porteuses d’implants mammaires à enveloppe texturée ont développé cette tumeur très rare. Problématique, quand on sait que les prothèses texturées, pointées du doigt dans les conclusions de l’ANSM dans la survenue de ce cancer, représentent 85% du marché français. Leader mondial de la prothèse mammaire, le fabricant américain Allergan s’est vu supprimer le marquage CE de son modèle texturé Biocell, désormais retiré du marché français, souvent utilisé en chirurgie réparatrice suite à un cancer du sein. De plus, le 21 novembre 2018, l’ANSM a recommandé aux professionnels de santé de ne plus opérer qu’avec des implants mammaires à enveloppe lisse, souhaitant éviter à l’avenir tout risque, aussi minime soit-il, de lymphome anaplastique à grandes cellules, qui, s’il n’est pas décelé assez tôt, peut mener au décès. L’autorité sanitaire rappelle également aux professionnels de santé qu’ils restent tenus d’informer leurs patientes sur les risques relatifs à la pose de prothèses mammaires. Pour autant, il n’a pas été préconisé aux porteuses de prothèses mammaires à enveloppe texturée un retrait préventif, comme cela avait été le cas lors du scandale PIP. Deux séries de plaintes ont néanmoins été déposées en février 2019 par des femmes victimes de complications graves liées à leurs prothèses mammaires, ont révélé France Info et Le Monde. En effet, une quinzaine de femmes victimes de complications engagent la responsabilité du fabricant de la prothèse tout comme celle de l’ANSM, dont les missions comptent celle de s’assurer de l’innocuité des dispositifs mis sur le marché. En France, on ne compte pas moins de 400,000 à 500,000 femmes portant des implants mammaires.
III – Une remise en question du marquage CE des prothèses mammaires déjà en route
Alors que plusieurs scandales concernant des dispositifs médicaux ont vu le jour ces dernières années, ce dernier rebondissement met une nouvelle fois à mal leur sécurité, et, en filigrane, leur contrôle. En effet, les dispositifs médicaux s’avèrent bien moins contrôlés que les médicaments, alors qu’ils présentent des risques tout aussi importants pour la santé humaine. Il s’agit pourtant de prothèses de hanche, mammaires, de pacemakers ou encore de stents, destinés à être implantés, souvent pendant de longues années, dans le corps de patients.
Pour autant, les dispositifs médicaux ne requièrent pas d’autorisation de mise sur le marché, contrairement aux médicaments, afin d’être commercialisés.
En effet, seul le « marquage CE » certifié par un organisme agréé est nécessaire afin de pouvoir les commercialiser, et l’obtenir n’a rien d’un parcours du combattant, puisque le produit n’est même pas testé par l’organisme. Aussi étonnant que cela puisse paraître, le fabricant doit uniquement présenter un dossier à l’organisme qu’il choisit, sans que le produit en lui-même ne soit présenté ou évalué. Depuis quelques années, une série d’événements indésirables liés à des dispositifs médicaux tels que ceux concernant des prothèses mammaires ont permis de s’interroger : comment de tels produits susceptibles de provoquer des complications importantes sur la santé humaine peuvent-ils être mis sur le marché avec autant de facilité ?
Si le système européen de contrôle des dispositifs médicaux comporte de graves lacunes, mises en lumière par de récents scandales, l’Union européenne a déjà entamé une révision des règles relatives à ces produits de santé. En effet, la sécurité des patients étant mise à mal, le Parlement européen a voté en avril 2017 un nouveau texte visant à unifier l’ensemble des acteurs du dispositif médical sous un seul règlement. Ce nouveau règlement a pour but d’améliorer la traçabilité et la transparence des dispositifs au niveau européen, mais aussi de de surveiller d’une meilleure manière les organismes délivrant le marquage CE. Le règlement sur les dispositifs médicaux est entré en vigueur le 26 mai 2017, et sera appliqué à compter du 26 mai 2020.